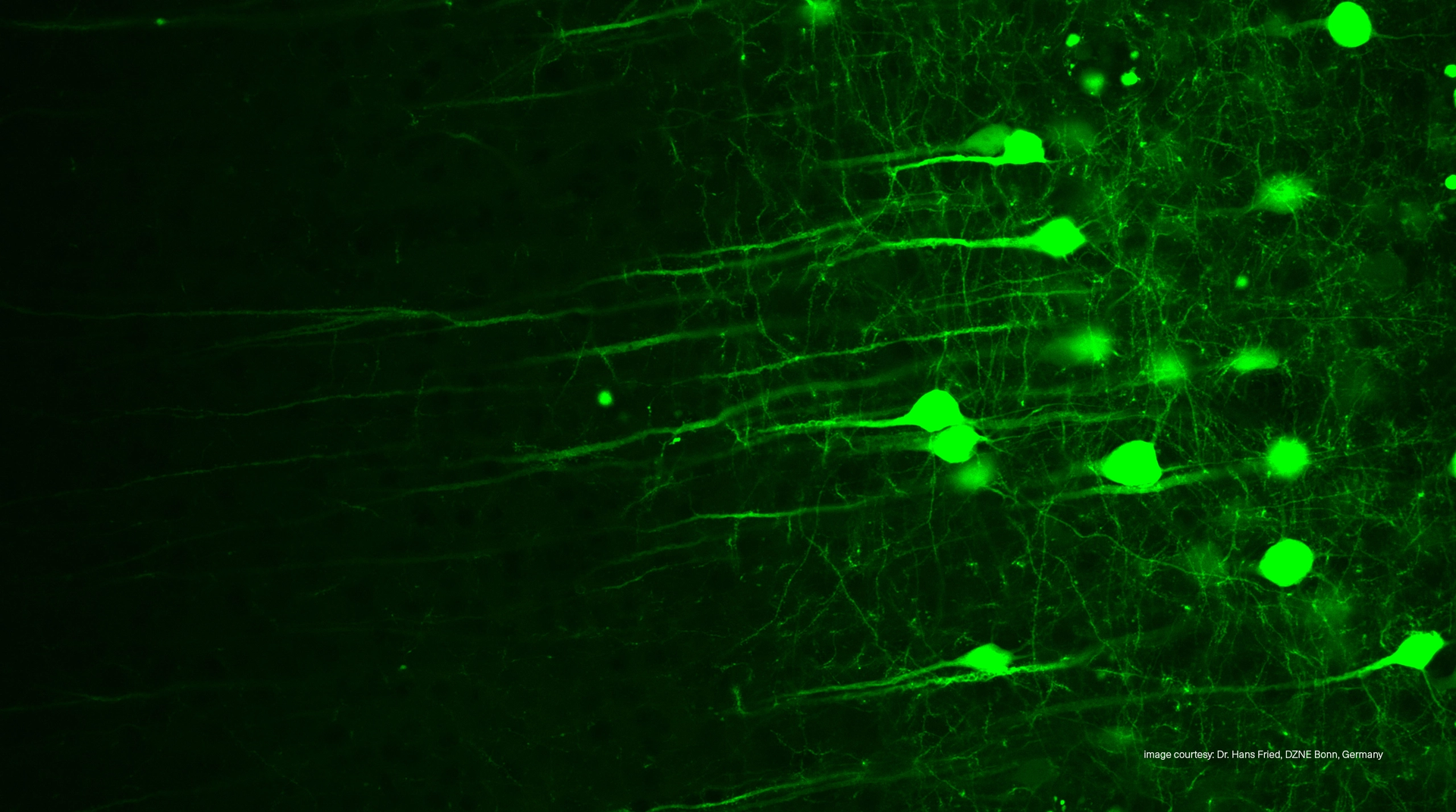
二光子顕微鏡 (TPEF)
より深く、明確に、優しく観察する
生体内で起こる最も魅力的な生物学的プロセスの多くは、生体組織の深部で進行します。しかし、光は散乱や吸収のため、通常その領域まで到達できません。
二光子励起蛍光顕微鏡(TPEF)はこの壁を打ち破り、損傷や歪みを与えることなく、完全な個体、ライブセル、さらには表面下数百マイクロメートルに広がる神経ネットワークまでも観察できるようにします。
二光子顕微鏡法は、レーザースキャニングの精密さと非線形光学の力を組み合わせ、深部でも、3Dでも、リアルタイムでも、細胞以下の分解能で可視化することを可能にします。
そして、この革新的なイメージング技術の中心にあるのがフェムト秒レーザーであり、超短パルスかつ高強度の光を放ち、二つの光子を同時に吸収させて蛍光を励起します。
原理:2つの光子、1つの励起
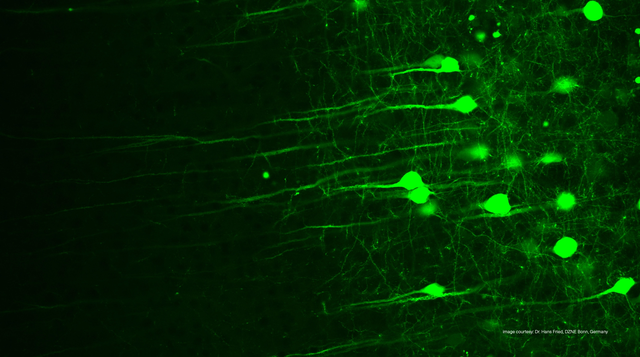
従来の(単一光子)蛍光顕微鏡では、蛍光分子は高エネルギーの光子を1つ吸収して励起状態に到達します。
一方、二光子顕微鏡では、同じ励起がより低いエネルギーの光子を2つ同時に吸収することで起こります。これらの光子は通常、近赤外(NIR)領域の光です。
二光子吸収が起こる確率は光強度に依存しており、強く集光されたフェムト秒レーザーの焦点付近でのみ発生します。
その結果として:
• 励起はごく小さな焦点体積に限定され、検出系にピンホールや共焦点アパーチャを用いる必要がなくなります。
• 焦点外でのフォトブリーチングや光損傷が大幅に抑えられます。
• 光の散乱が最小限に抑えられ、生体組織のより深部までイメージングできるようになります。
焦点を三次元的に走査することで、研究者は高解像度の光学的断層画像を得ることができます。
これは共焦点顕微鏡と同様ですが、より深く、そして試料に対してはるかに優しいという大きな利点があります。
なぜ二光子顕微鏡法が必要なのか
二光子顕微鏡法は、生体光学、神経科学、そして臨床イメージングの分野を一変させた技術であり、光学的断層化、深部組織への到達性、生細胞との高い適合性という独自の組み合わせを提供しています。
その主な利点としては、次の点が挙げられます。
- • より深い浸透深度(最大 1 mm、場合によってはそれ以上)
• 光毒性とフォトブリーチングの低減により、生体組織イメージングに最適
• 非線形励起による本質的な光学的断層化のため、ピンホールが不要
• 散乱の多い組織でも、大きな深さで高いS/N比を維持
• 単一のフェムト秒光源で、複数の蛍光色素や自家蛍光を同時に多色励起可能
これらの理由から、TPEF(二光子励起蛍光法)は現在、神経科学、発生生物学、そして生体内イメージングにおける標準的手法となっており、研究者が生体システムをリアルタイムで機能している状態のまま観察することを可能にしています。
二光子イメージングで一般的に用いられる生物試料
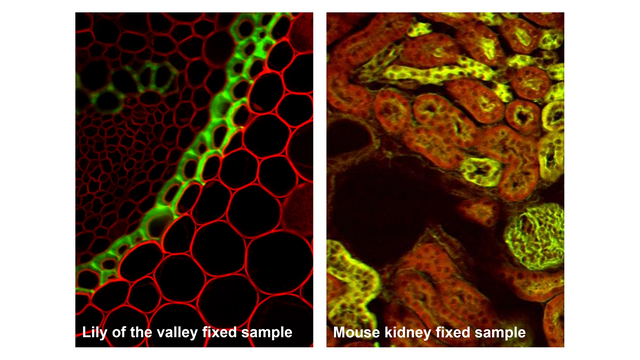
二光子顕微鏡法は、従来の顕微鏡では観察が難しい厚みのある、生きた、あるいは散乱性の高い試料の可視化に優れています。
- 脳組織:神経活動やシナプス動態の生体内イメージング。
- ゼブラフィッシュ、ショウジョウバエ、 C. エレガンス の胚:透明または半透明生物における発生生物学研究。
- オルガノイドや組織片:臓器発生や疾患研究のための 3D モデル系。
- 血管系や腫瘍微小環境:血流、血管新生、ドラッグデリバリーの観察。
- 皮膚や眼組織:非侵襲的な光学的生検や臨床イメージング。
生体試料の数百マイクロメートル深部まで構造を可視化できることから、二光子顕微鏡法は細胞・組織・ネットワークが本来の環境でどのように振る舞うかを研究するうえで欠かせない技術となっています。
フェムト秒レーザーの能力
非線形な二光子励起プロセスを効率的に駆動するためには、レーザーは以下の特性を備えている必要があります。
- 高いピークパワー(一般にフェムト秒パルスが必要)。
- 回折限界のビーム品質。
- 蛍光分子の吸収に適合した波長。
- 蛍光色素の蛍光寿命に適した繰り返し周波数(通常 20〜80 MHz)。
フェムト秒ファイバーレーザーは、その高い安定性、コンパクトさ、そして調整不要の運用性により、TPEF(Two-Photon Excited Fluorescence)の光源として主流となっています。従来のTi:サファイアレーザーと比べても、信頼性やメンテナンス性の面で優れています。
推奨される固定波長と蛍光色素
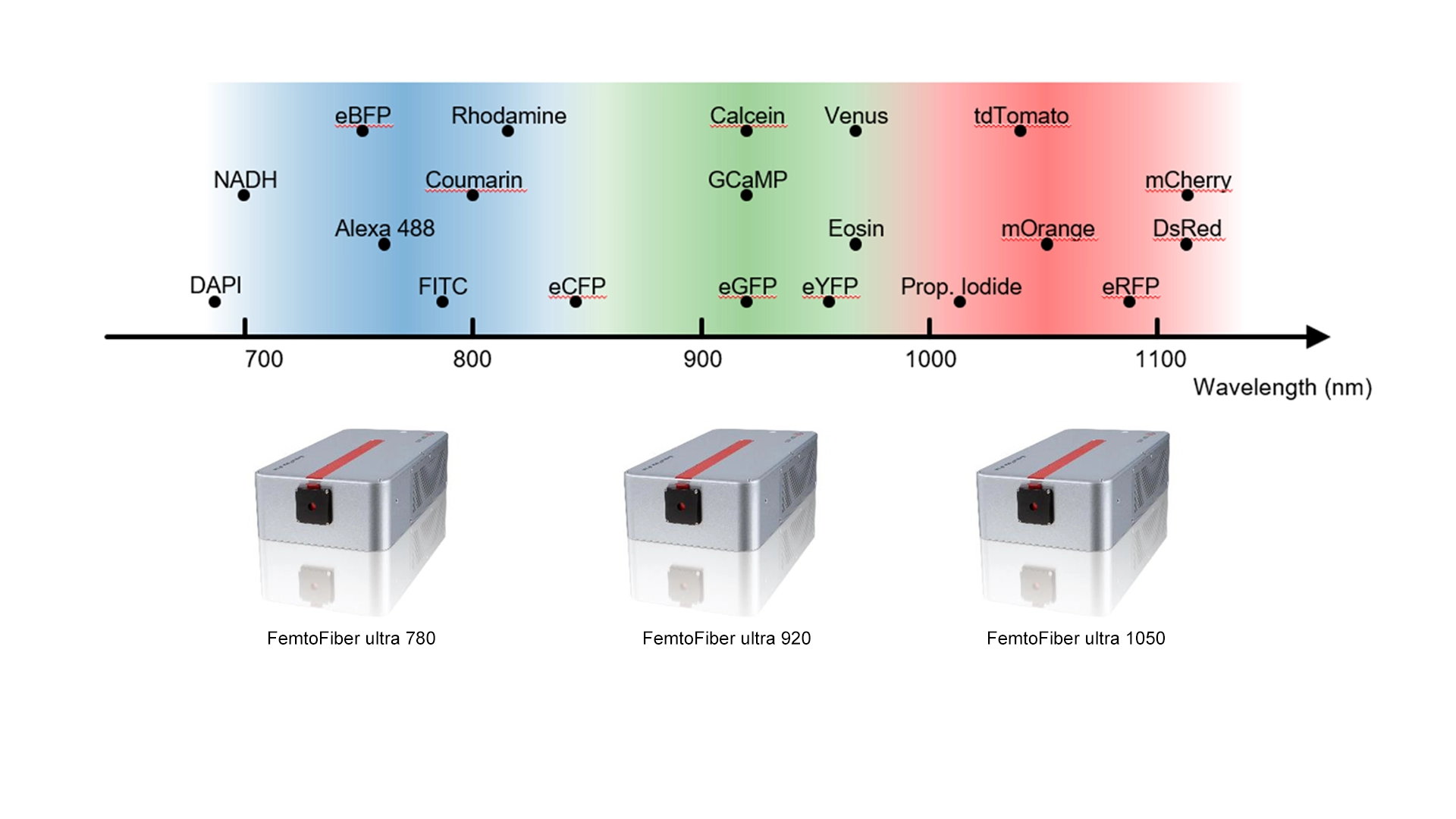
さまざまな蛍光色素や蛍光タンパク質は、それぞれ異なる励起波長を必要とします。
780 nm、920 nm、1050 nm の固定波長フェムト秒ファイバーレーザーは、二光子イメージングで使用される一般的な蛍光色素や自家蛍光プローブの大部分をカバーします。
| レーザー波長 | 主な蛍光 / 発色団 | アプリケーション例 |
|---|---|---|
| 780 nm | DAPI, Alexa Fluor 350, Fura-2, NADH | カルシウムイメージング、DNA染色、代謝イメージング |
| 920 nm | GFP, Alexa Fluor 488, Oregon Green, GCaMP, Eosin, CFP, FAD | 神経カルシウムイメージング、細胞トラッキング、代謝イメージング |
| 1050 nm | tdTomato, mCherry, Alexa 594, Rhodamine, RFP, mOrange | 深部組織赤色蛍光イメージング、二色イメージング |
適切な波長を選択することで、研究者はシグナル強度を最大化し、組織の加熱を最小限に抑え、目的とするアプリケーションに最適な侵達深度を得ることができます。
シンプル且つ安定したレーザー
TOPTICA のフェムト秒ファイバーレーザーは、生体関連の固定波長と堅牢なファイバーアーキテクチャを組み合わせ、要求の厳しい研究環境や臨床環境においてもプラグ&プレイで運用可能です。
バルキーでアライメントに敏感な Ti-Saレーザーや OPO システムと比較し、TOPTICA のフェムト秒ファイバーレーザーは以下の特長を備えています。
- 最高レベルの蛍光画像輝度を実現する Clean Pulse Technology
- 群遅延分散(GDD)事前補整のソフトウェア制御
- 内蔵音響光学素子(AOM)
- 極めてコンパクト、且つパッシブ冷却
- COOLACによるオプションのファイバー結合でシームレスに統合
- 高速でハンズオフの起動、ユーザーアライメント不要
- 数か月にわたり安定した性能
- パッシブ空冷による無騒音・無振動
ファイバー出力を備えたレーザーシステムでは、偏波保持型ホロ―コアファイバーを通じてレーザービームを直接顕微鏡へ導きます。これにより実験セットアップが大幅に簡素化され、ドリフトや振動への感度が最小化されます。
TOPTICA の COOLAC を用いることで、レーザーはハンズオフの自動ファイバー結合を実現し、設置時の手動アライメントを不要にし、ボタン一つで最適な結合状態に調整し、外部ツールや機器を使うことなく内部で結合効率をモニタリングできます。
特に Mini2P のような小型二光子顕微鏡にとって、このレーザー技術は大きな利点となります。
臨床向け二光子イメージングへをシンプルにする
近年まで、従来型の超短パルスレーザーシステムは、その複雑さと高コストのために、二光子顕微鏡の利用が専門的な研究施設に限られていました。
しかし、ファイバーベースのフェムト秒レーザーがその状況を変えつつあります。臨床環境やトランスレーショナル研究に適した、堅牢性とターンキー操作性を兼ね備えているためです。
このようなシステムの簡素化により、皮膚科、眼科、組織学、内視鏡分野において、臨床グレードの二光子イメージングシステムが実現に向けて大きく前進しています。
臨床応用の例
- 生体皮膚顕微鏡:患者のコラーゲン、エラスチン、メラニン構造を非侵襲的に観察します。
参考文献:K. Montgomery ほか, Handheld multiphoton and pinhole-free reflectance confocal microscopy enables noninvasive, real-time cross-sectional imaging in skin, Nature (2024) - 眼科診断:近赤外励起を用いて網膜層を高解像度でイメージングします。
- ラベルフリー病理:二光子自家蛍光と SHG(第二高調波発生)を組み合わせ、リアルタイムで組織を評価します。
新世代のコンパクトでファイバー結合型のフェムト秒レーザーは、二光子顕微鏡技術を研究室レベルから臨床応用へと広げる可能性をもたらしています。
参考文献
-
Multimodal optical coherence tomography and two-photon light sheet fluorescence microscopy for embryo imaging
Md Mobarak Karim et al, “Multimodal optical coherence tomography and two-photon light sheet fluorescence microscopy for embryo imaging”, Journal of Biomedical Optics, Vol. 30, Issue 6, 060501 (June 2025)
-
Influence of laser pulse shape and cleanliness on two-photon microscopy
Shau Poh Chong and Peter Török, "Influence of laser pulse shape and cleanliness on two-photon microscopy," Opt. Continuum 3, 552-564 (2024)
-
Femtosecond fiber delivery at 920 nm for two-photon microscopy
Konrad Birkmeier, et al., "Femtosecond fiber delivery at 920 nm for two-photon microscopy", Proc. SPIE 12847, Multiphoton Microscopy in the Biomedical Sciences XXIV, 1284703 (12 March 2024)
-
Evaluation of compact pulsed lasers for two-photon microscopy using a simple method for measuring two-photon excitation efficiency
Samir Saidi, Matthew Shtrahman, “Evaluation of compact pulsed lasers for two-photon microscopy using a simple method for measuring two-photon excitation efficiency“, Neurophotonics, Vol. 10, Issue 4, 044303 (November 2023)
-
Large-scale two-photon calcium imaging in freely moving mice
W. Zong, et al., Large-scale two-photon calcium imaging in freely moving mice, Cell https://doi.org/10.1016/j.cell.2022.02.017 (2022)
-
High energy (>40 nJ), sub-100 fs, 950 nm laser for two-photon microscopy
Ruihong Dai , et al., High energy (>40 nJ), sub-100 fs, 950 nm laser for two-photon microscopy, Optics Express, Vol. 29, Issue 24 (2021)
-
Robust functional imaging of taste sensation with a Bessel beam
J. Han, et.al., Robust functional imaging of taste sensation with a Bessel beam, Biomedical Optics Express 12, 5855 (2021)
-
Simplifying two-photon microscopy (2020)
Simplifying two-photon microscopy (2020)
-
Next generation two-photon microscopy using the FemtoFiber ultra 920 fiber laser
Dr. Max Eisele, Bernhard Wolfring "Next generation two-photon microscopy using the FemtoFiber ultra 920 fiber laser" (2019)
TOPTICA Photonics:
Bringing the light that lets us see deeper - into life, into function, into future.