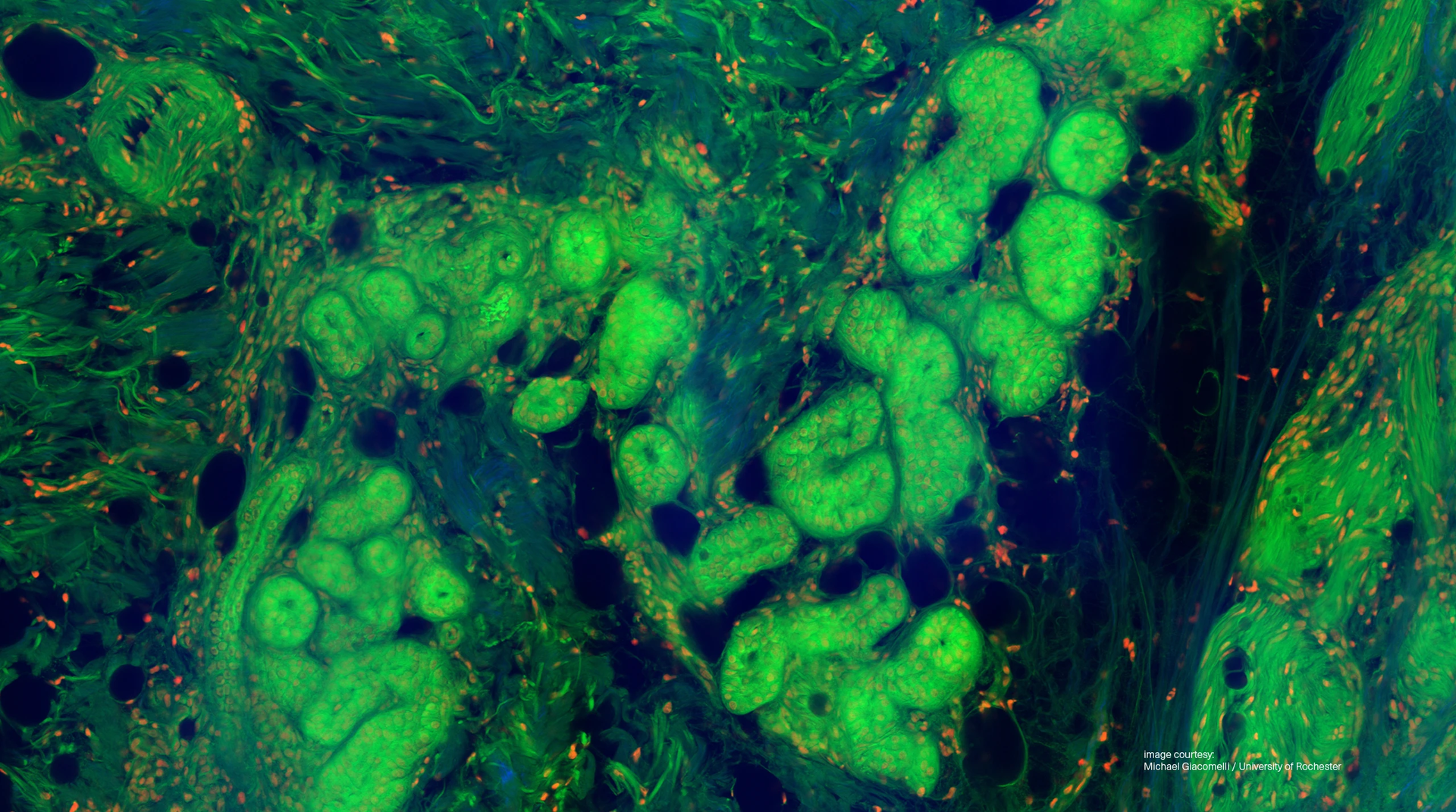
Thumbnail-Configuration
Please select a thumbnail configuration.
超解像顕微鏡
回折限界を超えて。- 分子レベルで生命を観察する
一世紀以上にわたり、光の回折限界は生物界をどれだけ細かく観察できるかを規定してきました。その限界は横方向で約200ナノメートル、深さ方向で約500ナノメートルです。今日、超解像顕微鏡がその限界を打ち破りました。
STED、SIM、PALM、STORMといった最先端の超解像技術は光学イメージングをナノスケール領域へと押し進め、かつては電子顕微鏡でしか観察できないと考えられていた、生きた、動的な、機能的な生物システムの細部を明らかにしました。
あらゆる超解像技術の背後には共通の要素があります。それは精密に設計されたレーザー光です。レーザー光はコヒーレントかつ高安定な動作を可能にし、複数の波長にわたって調整が可能です。レーザーは光場を"彫刻"する存在であり、研究者は光の波長よりも小さな生物学的構造を照らすことができます。
原理:光と巧みな物理学で回折を克服する
従来の蛍光顕微鏡法は光の波動性によって限界があり、約200 nmより近接した構造はぼやけてしまいます。
超解像顕微鏡法は非線形光学プロセス、構造化照明、あるいは単一分子の局在化を用いて、回折限界をはるかに超える画像を鮮明化または再構成することで、この限界を打ち破ります。
それぞれの技術は、異なる方法でこれを実現します。
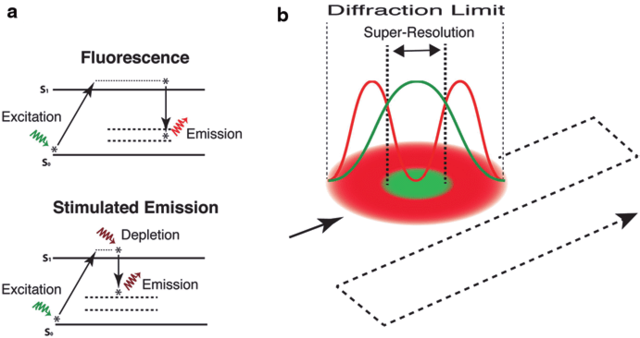
STED(誘導放出抑制顕微鏡)
STED(Stimulated Emission Depletion Microscopy)では2本の同期したレーザービームを使用します。
励起ビームは蛍光体を励起し、ドーナツ型の減衰ビームは蛍光体の中心を除くすべての領域で蛍光体を消光します。
その結果、回折限界以下の励起スポットが得られ有効蛍光領域は20~30nmの分解能まで縮小されます。減衰ビームの有効半径が小さいほど、分解能は高くなります。
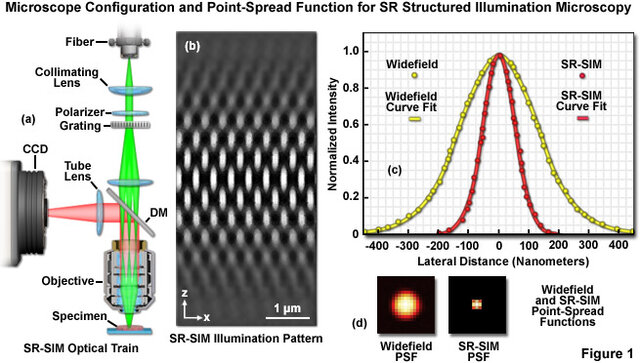
SIM(構造化照明顕微鏡)
SIM (Structured Illumination Microscopy)は干渉光パターン(格子)でサンプルを照射し、その結果生じるモアレ縞を解析することで高解像度の画像を再構成します。
これにより従来の顕微鏡の解像度が2倍になり、横方向分解能は約100nmに達します。これは中程度の光強度と標準的な蛍光色素を使用するため、生細胞イメージングに最適です。
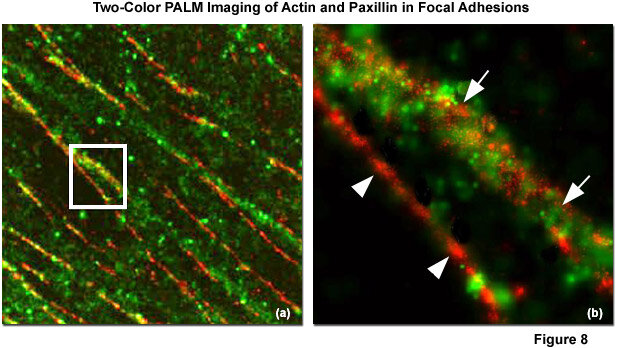
PALM & STORM(光活性化局在 / 直接確率的光再構成顕微鏡)
PALM(Photo-Activated Localization Microscopy)とSTORM (Stochastic Oprical Reconstruction Microscopy)は光スイッチング可能な蛍光分子を使用しますが、一度に活性化するのは分子のごく一部に限られます。
各発光点の中心をナノメートル単位の精度で特定し、数千枚のフレームを再構成することで10~30nmの解像度の画像を生成します。これにより分子の配列や相互作用を極めて詳細に明らかにすることができます。
超解像顕微鏡が重要な理由
超解像顕微鏡は現代のバイオフォトニクスにおける最も革新的な進歩の一つです。
研究者はタンパク質複合体やシナプスからクロマチン構造や膜組織に至るまで、生命の分子機構を直接観察することができます。
これらの技術は以下の分野で飛躍的な進歩をもたらしました:
- 神経科学:シナプス構造と神経伝達物質の動態のマッピング。
- 細胞生物学:細胞骨格フィラメントと細胞小器官の接触の可視化。
- ウイルス学:ナノスケールでのウイルスの侵入と複製の解明。
- ガン研究:タンパク質のクラスター化と受容体シグナル伝達の研究。
空間分解能、生細胞への適合性、分子特異性を組み合わせることで、超解像顕微鏡は生化学と細胞生理学の架け橋となります。
典型的な生物学サンプル
超解像顕微鏡は以下のような多様な生物系研究の試料に対して利用されています。
- 神経ネットワーク(シナプス小胞、アクチンフィラメント、樹状突起スパイン)
- 膜受容体クラスターおよびタンパク質集合体
- 細胞核内のクロマチン構造および転写フォーカス
- 微小管、ミトコンドリア、ゴルジ体ネットワーク
- ウイルス粒子および免疫シナプス
蛍光タンパク質(GFP、mCherryなど)および蛍光色素(Alexa Fluor、Atto、Cy色素など)は安定性とスイッチング挙動に基づいて選択されます。また励起波長によってレーザーの要件が決まります。
超解像顕微鏡におけるレーザーの役割
レーザーはあらゆる超解像顕微鏡における心臓部です。
レーザーは精密な励起、減衰、光活性化に必要な単色でコヒーレント、かつ時間的に制御された照明を提供します。
ナノメートルスケールの分解能を達成するには、レーザーには以下の要件が求められます:
- 様々な蛍光色素分子に対応する405~785 nmをカバーする複数の安定した波長。
- 均一で回折限界の集光を可能にする優れたビーム品質(TEM₀₀)。
- 長時間のデータ取得中の信号変動を防ぐ低ノイズと出力安定性。
- 時間ゲート励起またはパルス励起モードでの同期を可能にする高速変調。
- 減衰(STED)およびスイッチング(PALM/STORM)ビームのための高出力。
各超解像技術のレーザー要件
| 手法 | 典型的なレーザー / 波長 | パルス / 光出力に対する要求 | キーとなる技術 |
|---|---|---|---|
| STED | 励起用: 488, 561, 640 nm; 減衰用: 592, 775 nm | 高出力CWまたはパルス減衰 (~100 mW–1 W) | 優れたビーム品質、低タイミングジッタ、安定した偏光状態 |
| SIM | 405–640 nm (複数波長での励起) | 中出力CWまたは変調ビーム | 高いコヒーレンス、低い強度ノイズ、高速変調(<µs) |
| PALM / STORM | 405 nm (刺激用), 488/561/640 nm (励起用) | CWまたは変調日ビーム (10–100 mW) | 低ノイズ、長期安定出力、高精度変調制御 |
| Two-color PALM / STORM |
2波長レーザー, 一般的には 561 nm & 640 nm | 波長独立制御, 高い出力安定性 | 完璧な波長マッチングとクロストーク抑制 |
従来の共焦点顕微鏡と比較した利点
| 項目 | 共焦点顕微鏡 | 超解像顕微鏡 |
|---|---|---|
| 分解能 | 横方向約200 nm、軸方向約500 nm | 20–100 nm (STED, PALM/STORM), 100 nm (SIM) |
| 光退職 | 中程度から高い | SIMの:低い。STED/PALM: 最適化されていない場合は高い |
| サンプル種別 | 固定サンプルまたはライブサンプル | 生細胞対応(SIM、高速STED) |
| 測定の複雑さ | 比較的簡易な光学デザイン | 精密なレーザー制御 & 同期が必要 |
| 情報の種類 | 細胞小器官と構造 | 分子スケールの局在とダイナミクス |
まとめ:
超解像顕微鏡は光学顕微鏡の観察範囲を細胞レベルから分子レベルまで拡張し、研究者が生命の仕組みを分子一つ一つ観察することを可能にします。
課題と欠点
それぞれの手法には独自の長所とトレードオフが存在します。
- STED:最高の空間分解能(約20 nm)が可能な一方、高い減衰パワーと光安定性色素が必要。
- SIM:細胞への影響が小さく、高速かつ生細胞にも優しい一方、分解能は約100 nmに制限され再構成アルゴリズムが複雑。
- PALM/STORM:究極の単一分子精度(10~20 nm)を誇る一方、画像取得に時間がかかり蛍光色素の明滅に画像品質が依存する。
生物研究者はダイナミクス観察にはSIM、微細構造観察にはSTEDといった異なる手法を組み合わせることで、レーザーの柔軟性を活かしたハイブリッドイメージングシステムを構築する例が多く見られます。
最新のレーザー技術:多波長ファイバー結合システム
最新のマルチカラーレーザーエンジンは単一のファイバー出力を介して紫外から近赤外(405~785 nm)の複数の波長を同時に供給します。
COOL ACアクティブ温度制御などの機能により長期的な出力とビームポインティングの安定性が確保され、ダイレクトダイオード変調により、時間ゲートまたは高速スキャンセットアップに不可欠なナノ秒単位の波長ライン間スイッチングが可能になります。
このコンパクトなレーザーシステムは、顕微鏡への組み込みを大幅に簡素化し、アライメントドリフトを最小限に抑えることで、研究施設とコア施設の両方で、ターンキー方式のマルチカラー超解像イメージングを実現します。
超解像顕微鏡による科学的ブレークスルー
超解像顕微鏡は、生物イメージングに根本的な変革をもたらしました。
- ナノメートルスケールでの細胞骨格の解明:
研究者らはSTEDを用いて、生細胞におけるアクチンと微小管の組織化を20nmの精度で可視化しました(Hell et al., Nature, 2000)。 - シナプスにおけるタンパク質の局在のマッピング:
PALMイメージングは、神経伝達物質受容体が神経細胞膜内でどのようにクラスターを形成するかを明らかにしました(Betzig et al., Science, 2006)。 - クロマチン構造と遺伝子発現:
STORMは活性DNA領域と不活性DNA領域が核内でどのように組織化するかを明らかにし、転写制御に関する知見をもたらしました。 - ウイルス感染経路:
SIMとSTORMはウイルスが宿主細胞に侵入し、脱殻する様子を可視化し、抗ウイルス戦略の標的を明らかにしました。
障壁を打ち破る光の力
超解像顕微鏡は、顕微鏡光学とレーザー技術における数十年にわたる革新の集大成です。
複数の安定化波長、高いビーム品質、そして超低ノイズを組み合わせることで、TOPTICAのレーザーソリューションは研究者が回折限界を超え、ナノメートルスケールで生物学を探求することを可能にします。
TOPTICA Photonics:
「限界を超えた生命領域」一つひとつの分子から明らかにする光をお届けすることを約束します。